Régulateur intégrateur pour cellules
Des chercheurs de l'ETH développent un circuit de régulation intégrateur pour les cellules vivantes en utilisant une stratégie d'ingénierie éprouvée. Cela pourrait contribuer à ce que les cellules puissent fabriquer des quantités précisément régulées d'un produit.
De nombreuses applications techniques actuelles ne peuvent plus s'en passer : les circuits de régulation intégrateurs (en anglais integral feedback control). De tels systèmes de régulation maintiennent les avions à une altitude donnée, un véhicule à une vitesse constante sur l'autoroute ou un four industriel à la même température. Gr?ce à un tel système de régulation, on obtient généralement une "adaptation parfaite et robuste" aux perturbations.
Par adaptation parfaite et robuste, on entend que le système de régulation se stabilise toujours sur la valeur de consigne préréglée, indépendamment des perturbations externes ou des paramètres du système que l'on souhaite réguler. Une boucle de régulation y parvient en intégrant la réaction du système à réguler au fil du temps. Le signal qui en résulte sert à son tour à corriger le système à réguler.
La biologie les a inventés
De telles boucles de régulation se retrouvent également en biologie. Elles régulent la température corporelle d'un animal à sang chaud ou l'équilibre du calcium chez les mammifères. Au niveau cellulaire, elles sont responsables du maintien de l'équilibre cellulaire, ce que l'on appelle l'homéostasie.
Mais il n'existait pas jusqu'à présent de circuit de régulation biologique synthétique capable d'intégrer les réactions du système au fil du temps. Le grand défi réside dans le fait qu'il existe en permanence un fort bruit de fond dans les cellules vivantes. Ce bruit provient de molécules qui réagissent entre elles de manière aléatoire et qui ne sont présentes qu'en très petites quantités. Ces molécules peuvent aussi devenir soudainement plus fréquentes, mais aussi dispara?tre complètement pendant une longue période - le hasard joue alors un grand r?le.
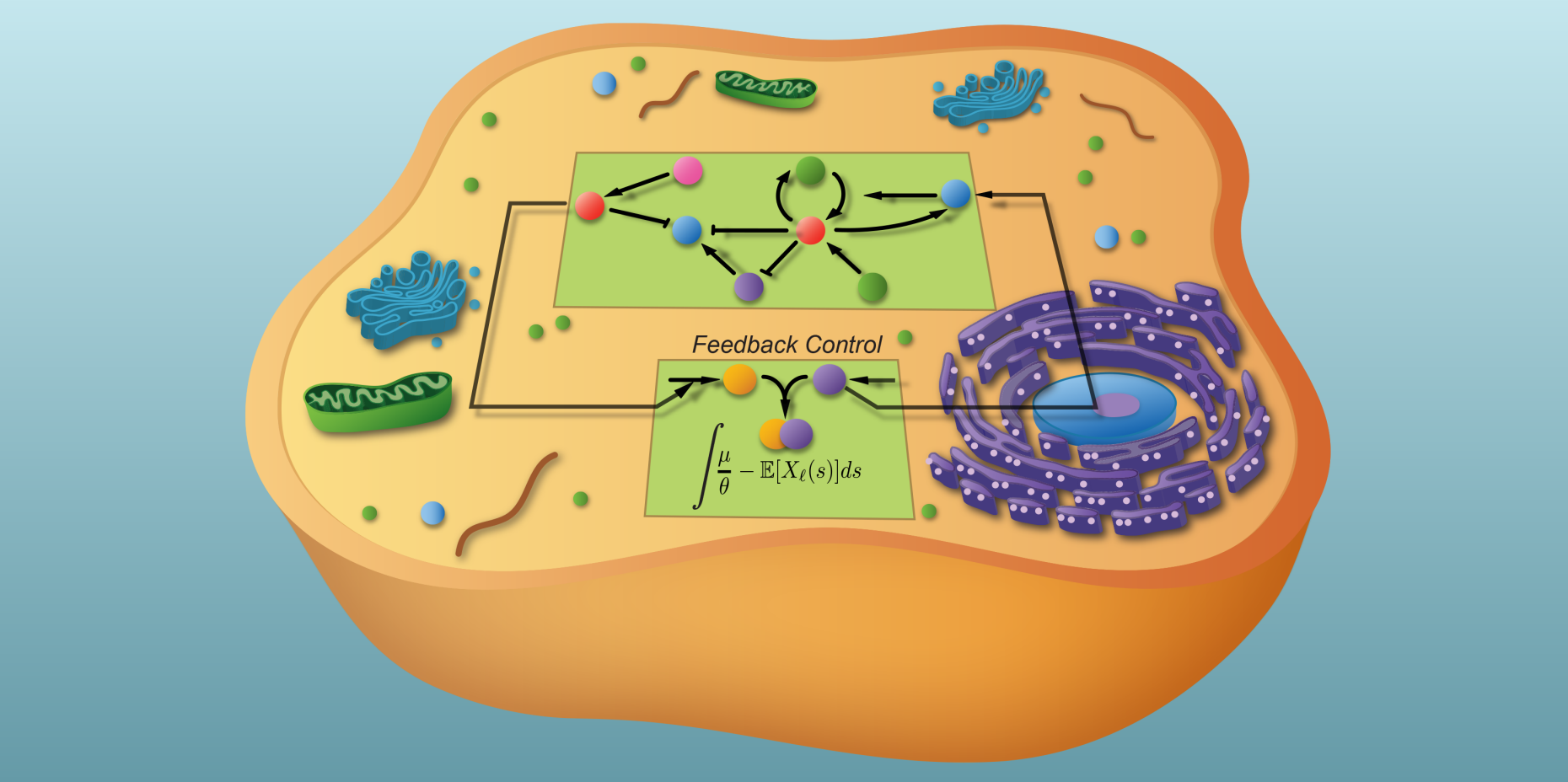
Boucle de régulation artificielle dans une cellule
Mustafa Khammash, professeur de théorie de la régulation et de biologie systémique au Département des systèmes biologiques de B?le, et ses collaborateurs Corentin Briat et Ankit Gupta présentent aujourd'hui une nouvelle approche à ce problème. Dans l'un des derniers numéros de "Cell Reports", ils présentent comment une telle boucle de régulation intégrée peut fonctionner dans une cellule, afin qu'une molécule puisse être produite en quantités précises et régulées malgré un bruit important. Les chercheurs appellent leur régulation "contr?le de rétroaction intégré antithétique" (antithetic integrated feedback control, AIFC).
L'AIFC se compose de deux réseaux : un réseau qui doit être régulé et un autre réseau qui fonctionne comme unité de contr?le et qui régule le premier. L'interconnexion des deux réseaux permet l'adaptation parfaite recherchée.
"Nous avons con?u la boucle de régulation de manière à ce qu'elle réponde à trois points importants de la technique de mesure et de régulation dans des systèmes marqués par le hasard : Il doit être stable, la valeur de consigne doit être réglable et il doit permettre une adaptation parfaite robuste", explique Khammash. Ce système doit en outre fonctionner sans erreur dans une mer agitée.
Le bruit stabilise le système
Pour ce faire, les chercheurs ont créé une nouvelle théorie de régulation ainsi qu'un modèle informatique pour la technique de régulation au niveau moléculaire. Ils réfutent ainsi l'hypothèse erronée selon laquelle le bruit est toujours préjudiciable à un système de régulation. Avec leur nouveau système, ils démontrent même au contraire que le bruit de fond dans la cellule est un avantage pour atteindre l'adaptation robuste parfaite visée. "Sans le bruit moléculaire, la réponse du système commence à fluctuer", explique le professeur de l'ETH. Si l'on ajoute à nouveau le bruit, la réponse du système s'adapte parfaitement à la valeur de consigne souhaitée.
Afin d'étayer leur approche théorique, les chercheurs ont cherché un AIFC naturel - et ont trouvé ce qu'ils cherchaient. Dans la bactérie Escherichia coli il existe une cha?ne de signalisation et de production de protéines qui est effectivement construite selon les théories des scientifiques.
Contr?le génétique gr?ce à la régulation intégrative
Dans ce circuit de régulation intégrateur, la valeur de consigne est la quantité moyenne d'un complexe de molécules composé d'un facteur sigma (s70) et d'une ARN polymérase (RNAP). Ce complexe lance la transcription, c'est-à-dire la lecture des gènes pour la fabrication de l'ARN, le mode d'emploi d'une protéine. La bactérie a besoin des protéines concernées de cette cha?ne de signalisation pour sa croissance.
Afin que la production de protéines ne devienne pas incontr?lable, une protéine est également construite en tant que "sous-produit", qui, en tant qu'anti-s70, se lie fermement au facteur s70 et le retire de la circulation. En conséquence, il se forme moins de complexes RNAP-s70. Le taux de transcription diminue ainsi que le niveau d'anti-s70 dans la cellule, de sorte que les molécules s70 nouvellement produites peuvent à nouveau se combiner en complexes RNAP-s70. La production de protéines augmente à nouveau.
Les chercheurs démontrent par leurs calculs que ce système, qui contient leur motif AIFC, tend vers une valeur stable du complexe. Ce faisant, la concentration moyenne du complexe sera juste correcte afin de pouvoir générer à son tour la bonne concentration d'anti-s70.
Paradoxe résolu
D'après les calculs des scientifiques, la forme libre du s70 n'est présente qu'en très petites quantités. Comment celle-ci peut-elle même agir comme régulateur si elle n'est presque jamais présente ? "C'est là qu'intervient le bruit dans la cellule", explique Khammash. La fréquence d'une protéine de régulation comme s70 varie de manière aléatoire. Pourtant, une mesure statistique de son caractère aléatoire, comme la fréquence moyenne dans le temps, agit comme un signal de régulation dit déterministe. "Pour réaliser une boucle de régulation intégrative à l'aide de molécules extrêmement rares, il est essentiel de tenir compte de la disponibilité moyenne de ces molécules, qui évolue au fil du temps", souligne le professeur de l'ETH.
Avec leur étude, Khammash et ses collaborateurs résolvent un paradoxe. En biologie, il existe de nombreux exemples magnifiques d'homéostasie et d'adaptation robustes. Ceux-ci suggèrent qu'il existe des boucles de régulation intégratives. Mais on ne comprend pas comment la biologie a mis en ?uvre ces boucles de régulation, écrit le professeur de Caltech John Doyle dans un commentaire sur la publication des chercheurs de l'ETH. Cette énigme est d'autant plus déconcertante si l'on considère que les molécules présentes en petit nombre sont une garantie de bruit important, mais que l'adaptation se produit tout de même. Le travail des chercheurs b?lois permet de résoudre ce paradoxe. En effet, si les bactéries souhaitent contr?ler leur comportement par le biais d'un petit nombre de composants, le bruit serait alors un grand avantage.
Gr?ce à cette étude, Khammash et ses collaborateurs ont posé les bases pour optimiser de futurs réseaux de régulation synthétiques, qui fonctionnent comme des boucles de contr?le intégratrices. De tels réseaux pourraient par exemple être con?us pour produire de manière stable et robuste les quantités souhaitées de substances médicales actives, de certaines hormones comme l'insuline ou de carburants produits biologiquement.
Référence bibliographique
Briat C, Gupta A, Khammash M : Antithetic Integral Feedback Ensures Robust Perfect Adaptation in Noisy Biomolecular Networks. Cell Systems 2016, 2 : 15-26, doi : page externe10.1016/j.cels.2016.01.004
Doyle J. Même les réponses bruyantes peuvent être parfaites si elles sont intégrées correctement. Cell Systems 2016, 2 : 73-75, doi : page externe10.1016/j.cels.2016.02.012