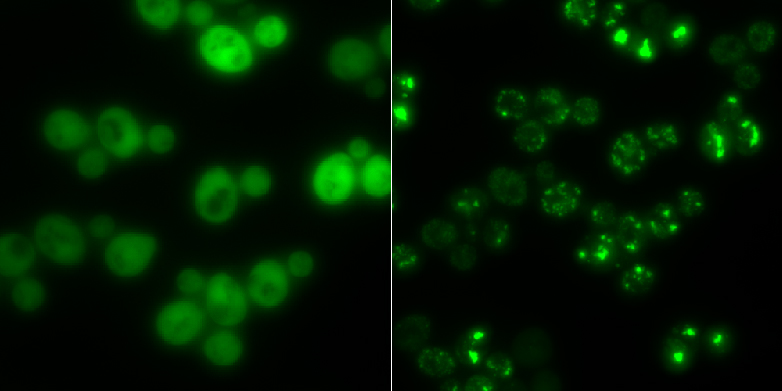
Des grumeaux comme dép?t intermédiaire
Des chercheurs de l'ETH ont découvert que la formation d'agrégats de protéines dans les cellules de levure est réversible. Cela apporte également un nouvel éclairage sur les maladies humaines attribuées à de tels agrégats.
Les agrégats de protéines ont mauvaise réputation : de nombreuses maladies humaines, notamment celles du système nerveux comme la maladie d'Alzheimer, la maladie de Parkinson ou la sclérose latérale amyotrophique (SLA), sont dues au fait que des protéines dégénérées s'accumulent dans les cellules nerveuses et forment ainsi des agrégats que les cellules ne peuvent pas dissoudre. Les cellules meurent alors.
Dans une étude menée sur des cellules de levure, des chercheurs dirigés par le professeur ETH Matthias Peter et Reinhard Dechant placent désormais les agrégats de protéines sous un jour nouveau. Le travail correspondant vient de para?tre dans la revue spécialisée "Nature Cell Biology". Les scientifiques de l'ETH y démontrent que de tels agrégats de protéines se forment dans les cellules de levure en cas de facteurs de stress tels que la privation de nourriture ou la chaleur. Une fois le stress surmonté, les cellules peuvent à nouveau dissoudre les agrégats et recycler rapidement les différents composants pour les utiliser dans le métabolisme cellulaire.
En cas de stress, des grumeaux se forment
Comme exemple de protéine qui s'agglutine en cas de stress, les chercheurs ont découvert l'enzyme Cdc19. Elle fournit de l'énergie à la cellule. Les chercheurs ont découvert que lorsque la Cdc19 est privée de glucose, elle se décompose en ses quatre sous-unités identiques. Celles-ci changent alors de forme initiale et se rassemblent en agrégats avec d'autres molécules comme les acides ribonucléiques ou d'autres enzymes. Les chercheurs appellent ces agrégats des granules de stress (en anglais stress granules). Une fois intégré dans un tel agrégat, le Cdc19 devient inactif et n'est plus en mesure de produire du carburant pour la cellule. Pendant ce temps, la cellule ne peut ni cro?tre ni se reproduire.
Le processus est toutefois réversible. Dès que le stress est terminé, les corpuscules de stress se dissolvent, les quatre sous-unités de Cdc19 se regroupent et l'enzyme peut alors reprendre son travail dans le métabolisme des sucres.
Les amas ont donc un but précis, explique Matthias Peter : "La cellule de levure utilise des agrégats comme une sorte de dép?t pour des enzymes importantes, afin qu'elles ne soient pas dégradées en situation de stress et qu'elles puissent être réactivées immédiatement après avoir survécu au stress". Les agrégats protégeraient ces molécules de la dégradation par la machinerie d'élimination de la cellule. Si la cellule devait reconstituer ces composés après chaque situation de stress, cela lui prendrait beaucoup de temps et d'énergie.
Une simple séquence suffit à l'agglutination
Les chercheurs ont également expliqué comment et pourquoi le Cdc19 peut s'agglutiner. Ils ont identifié dans la structure d'une sous-unité de Cdc19 une partie courte, non pliée et de structure simple. Dans le langage technique, de telles zones sont appelées "Low Complexity Regions" (LCR). Selon les chercheurs, elles sont également présentes dans d'autres protéines formant des agrégats dans d'autres organismes, notamment chez l'homme.
"Les LCR sont exposés par la décomposition du complexe enzymatique et déclenchent l'agrégation", sait Peter. "Il était donc important pour nous de repérer une telle séquence chez Cdc19. Chez la levure, la LCR de Cdc19 est normalement cachée ou porte plusieurs groupes phosphates qui la rendent "inopérante". Ce n'est qu'en cas de stress nutritionnel que la LCR appara?t et que les groupes phosphates sont retirés. Ce n'est qu'alors que des agrégats peuvent se former.
Une découverte importante
"Notre recherche a créé une atmosphère de renouveau dans la communauté scientifique", explique Reinhard Dechant, chef de groupe à l'Institut de biochimie, qui a dirigé l'étude avec Matthias Peter. Jusqu'à présent, on considérait surtout les agrégats comme des particules pathogènes, car on ne voyait toujours chez les patients que le résultat du processus - des plaques de protéines insolubles qui provoquent une maladie. "Notre travail met également en lumière le début de la formation d'agrégats et son évolution", explique Dechant. Les amas de protéines ne se forment pas exclusivement en raison d'une maladie, mais parce que la cellule en a besoin pour survivre à une situation de stress. "Nous avons pu montrer pour la première fois que tant la formation que la dissolution d'agrégats est un mécanisme important des cellules".
D'autres groupes de recherche de l'ETH Zurich sont parvenus auparavant à des conclusions similaires en étudiant de tels agrégats dans des cellules de levure. D'autres scientifiques de l'ETH ont ainsi pu démontrer que les amas de protéines dégénérées fonctionnent notamment comme une mémoire et aident les cellules à stocker les expériences (négatives) passées. (Actualités ETH ont rapporté). Il semble donc que l'agrégation fonctionnelle de certaines protéines constitue un mécanisme de régulation largement répandu.
Référence bibliographique
Saad S, Cereghetti G, Feng Y, Picotti P, Peter M, Dechant R. L'agrégation réversible des protéines est un mécanisme de protection pour assurer le redémarrage du cycle cellulaire après un stress. Nat Cell Biol. 2017 Oct;19(10):1202-1213. doi : page externe10.1038/ncb3600. Epub 2017 Aug 28.