Zelluläres Kräftemessen
Biologische Zellen k?nnen sich ausdehnen und zusammenziehen und mit Nachbarzellen wechselwirken. Wo dabei welche Kr?fte wirken, k?nnen ETH-Forscher dank einer verbesserten Mikroskopiemethode einfacher und genauer bestimmen. Die Technik wird beispielsweise in der Krebsforschung verwendet.
Ein interdisziplin?res Team von Wissenschaftlern der ETH Zürich hat eine neue Mikroskopietechnik entwickelt. Damit k?nnen die Forschenden sehr detailliert Kr?fte messen, welche biologische Zellen aufbringen, wenn diese wachsen, ihre Form ?ndern oder sich fortbewegen. Bei der neuen Methode handelt es sich um eine Weiterentwicklung der Traktionskraftmikroskopie (engl. traction force microscopy, TFM). Damit k?nnen Forscher diese Zellkr?fte einfacher und h?her aufgel?st messen als mit bisherigen Verfahren.
Elastische Unterlage
?Die heute g?ngigsten Ausführungen der Traktionskraftmikroskopie nutzen eine elastisch verformbare Unterlage und darin eingelassene mikroskopisch kleine fluoreszierende Referenzpunkte?, erkl?rt Dimos Poulikakos, Professor für Thermodynamik und Leiter des Forschungsprojekts. Auf diesen Unterlagen k?nnen Wissenschaftler im Laborexperiment Zellen wachsen lassen. Wenn sich diese zum Beispiel nach der Gabe eines Botenstoffs verformen, wird die Unterlage ebenfalls verformt, sodass sich die Referenzpunkte verschieben.
In diesem Zustand fotografieren die Wissenschaftler Zellen und Referenzpunktteppich unter dem Mikroskop ein erstes Mal. Schliesslich entfernen sie die Zellen, worauf sich die Unterlage in die Ursprungsform zurückzieht. Die Forschenden fotografieren dann den elastischen Teppich ein zweites Mal. Beim Vergleichen der Punktmuster auf den beiden Fotos k?nnen sie computerunterstützt für jeden Punkt der Zelle bestimmen, um welche Distanz er die elastische Unterlage zu verschieben vermochte. Weil auch die physikalischen Eigenschaften der Unterlage bekannt sind, kann man die dort wirkenden Kr?fte bestimmen.
Regelm?ssiges Muster
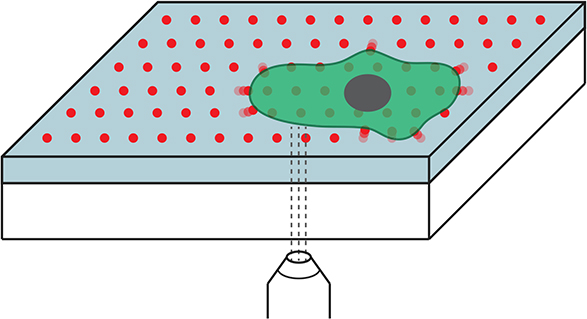
In bisherigen TFM-Ausführungen wurden die fluoreszierenden Referenzpunkte zuf?llig in das Unterlagenmaterial eingelassen. Den Forschern um Poulikakos ist es nun erstmals gelungen, diese Punkte in einem regelm?ssigen Gittermuster auf einer Silikon-Unterlage gezielt anzuordnen. Sie nutzten dazu Nanodrip, eine vor wenigen Jahren im Labor von ETH-Professor Poulikakos entwickelte 3D-Nanodrucktechnik.
Die regelm?ssige und klar definierte Anordnung der Orientierungspunkte bringt Vorteile. ?Wir müssen nun nicht mehr Zellen entfernen und ein Vorher- mit einem Nachher-Bild vergleichen. Stattdessen k?nnen wir die Kr?fte mit einem einzigen Mikroskopiebild bestimmen?, sagt Aldo Ferrari, Oberassistent in Poulikakos Gruppe. Somit k?nnen die Wissenschaftler Zellen neu über eine l?ngere Zeit beobachten und zum Beispiel zu verschiedenen Zeitpunkten mehrmals messen, wie Botenstoffe die Kr?fte einer Zelle beeinflussen.
Zusammenarbeit mehrerer Forschungsgruppen
Die technische Weiterentwicklung war m?glich dank der engen Zusammenarbeit von zahlreichen ETH-Forschern: So bestimmte das Labor von ETH-Professor Edoardo Mazza die physikalischen Eigenschaften der Silikon-Unterlage und entwickelte numerische Modelle, die es erm?glichen, aus der Deformation der Unterlage die verursachenden Kr?fte genau zu berechnen. ETH-Professorin Olga Sorkine-Hornung und Daniele Panozzo, Professor an der New York University, trugen zur computergestützten Berechnung der effektiven Verschiebung der Punkte aus den Mikroskopiebildern bei.
Ausserdem verwendeten die Wissenschaftler als Fluoreszenzfarbstoffe für das Orientierungsgitter blau, grün oder rot leuchtende Quantenpunkte (engl. quantum dots), dies in Zusammenarbeit der Gruppe von ETH-Professor und Quantenpunkt-Experte David Norris. Quantenpunkte sind Nanostrukturen aus Halbleitermaterialien mit massgeschneiderter Geometrie.
Genauer und in 3D
Die neue Methode hat noch weitere Vorteile: Sie ist genauer als bisherige Methoden. Auch ist es erstmals m?glich, die Traktionskraftmikroskopie (und somit zellul?re Kraftmessungen) mit der Immunhistochemie zu kombinieren. Letzteres ist eine verbreitete zellbiologische Methode, bei der bestimmte Zellkomponenten mit fluoreszierenden Antik?rpern sichtbargemacht werden. ?Wir k?nnen damit in einem Mikroskopiebild gleichzeitig das Vorhandensein eines bestimmten Proteins und die wirkenden Kr?fte anzeigen und dabei Zusammenh?nge erkennen?, sagt Ferrari. ?Das erm?glicht eine neue Art von zellbiologischen Experimenten.?
Und schliesslich ist es dank der Weiterentwicklung auch erstmals m?glich, Kr?fte in Zellen nicht nur zweidimensional, sondern dreidimensional zu bestimmen. ?Wir verwenden die Konfokalmikroskopie. Damit k?nnen wir von der Silikon-Unterlage und von der Zelle Schicht für Schicht mehrere Bilder aufnehmen und diese rechnergestützt zu einem 3D-Bild zusammensetzen?, sagt Ferrari.
Anwendung in der Krebsforschung
?Das neue System ist einfach zu brauchen und bereit für Anwendungen?, sagt Poulikakos. Die entwickelte Software ist quelloffen: Die ETH-Forschenden stellen sie Kollegen kostenlos zur Verfügung. Interessierte Wissenschaftler müssen im Labor allerdings die Nanodrucktechnologie anwenden k?nnen, um Quantenpunkt-Silikon-Unterlagen herzustellen.
Eingesetzt werden kann das neue System in der zellbiologischen und biomedizinischen Forschung, etwa zum Studium von Bewegungsabl?ufen von Zellen oder für Messungen von Wechselwirkungen zwischen Zellen und Implantaten. So pflegt Poulikakos‘ Gruppe beispielsweise eine Zusammenarbeit mit Krebsforschern des Politecnico di Milano. Dabei untersuchen sie in einer Karzinom-Art wie die Aktivit?t einzelner Gene und die Beweglichkeit von Zellen im Gewebe sowie die dabei wirkenden Kr?fte zusammenh?ngen.
Literaturhinweis
Bergert M et al.: Confocal reference free traction force microscopy, Nature Communications 2016, doi: externe Seite 10.1038/ncomms12814
