Eine ganz besondere Proteinmaschinerie
Der Erreger der Schlafkrankheit enth?lt eine aussergew?hnliche Maschinerie für die Herstellung von Proteinen. Eine Gruppe von Wissenschaftlern der ETH Zürich und der Universit?t Bern hat nun erstmals deren Struktur aufgekl?rt.
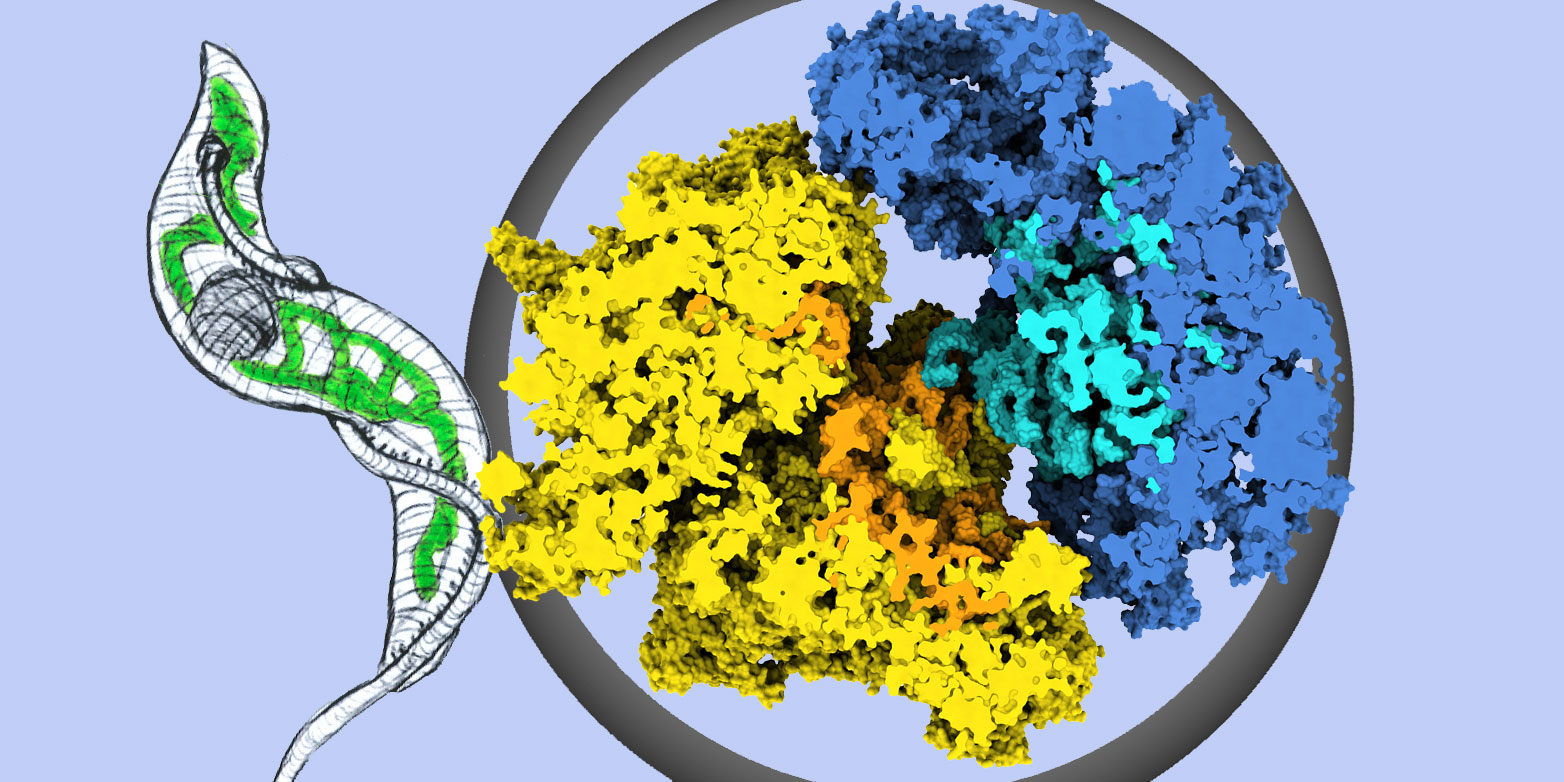
Ribosomen geh?ren zu den wichtigsten und im Verlauf der Evolution kaum ver?nderten molekularen Maschinen der Zelle. Ihre Funktion ist es, Abschriften von Genen, also Baupl?ne für Proteine, abzulesen und in Proteine zu ?übersetzen?.
Forschungsgruppen der ETH Zürich und der Universit?t Bern haben nun mittels Kryo-Elektronenmikroskopie die detaillierte atomare Struktur von ganz speziellen Ribosomen aufgekl?rt, die in den Mitochondrien von Trypanosoma brucei vorkommen, einem parasit?ren Einzeller, der die Schlafkrankheit verursacht. Ihre Erkenntnisse erschienen soeben in der Fachzeitschrift ?externe Seite Science?.
Mitochondrien sind Organellen, die in allen eukaryotischen Zellen zu finden sind. Sie sind die Kraftwerke der Zelle und enthalten eigene Ribosomen, sogenannte ?Mitoribosomen?. Diese stellen einige wenige, aber für diese Kraftwerke essentielle Proteine her. Mitoribosomen der Trypanosomen haben die gleichen Grundfunktionen wie die Ribosomen anderer Organismen, zum Beispiel denen des Menschen. Sie sind jedoch spezialisiert für die Biologie der Parasiten, und ihre Struktur sieht v?llig unterschiedlich aus.
Proteine in der Mehrzahl
Alle Ribosomen bestehen aus zwei Typen von Bausteinen: Ribonukleins?uren (RNA) und Proteinen. ?Interessanterweise sind die Mitoribosomen von Trypanosomen wesentlich gr??er als alle anderen Ribosomen einschliesslich der menschlichen Ribosomen?, sagt ETH-Professor Nenad Ban. Die Mitoribosomen von Trypanosomen bestehen zudem vorwiegend aus Proteinen, w?hrend alle anderen Ribosomen einen sehr hohen RNA-Anteil aufweisen. Folglich haben in den trypanosomalen Mitoribosomen die Proteine die strukturelle Funktion der RNA übernommen.
Folgende Analogie mag hier hilfreich sein: Ein kleines Holzhaus sieht nicht gleich aus wie ein grosser Betonbau, trotzdem brauchen beide ein Dach, Fenster, eine Treppe und so weiter. ?Vergleicht man die Architektur der vor allem aus Proteinen bestehenden trypanosomalen Mitoribosomen mit der RNA-basierten Ribosomenarchitektur anderer Organismen, kann man die grundlegendsten funktionellen Elemente und Bausteine definieren, die von allen Ribosomen geteilt werden?, erkl?rt der Forscher weiter.
M?glicher Therapieansatz
Trypanosomen nicht nur ein wichtiges Modellsystem für die Grundlagenforschung, sondern als Erreger der unbehandelt t?dlich verlaufenden Schlafkrankheit auch von klinischer Bedeutung. Die Mitoribosomen sind für das ?berleben der Trypanosomen absolut notwendig. Da sie ganz anders aufgebaut sind als die Mitoribosomen des Menschen, k?nnten sie sich als Angriffspunkt für eine Therapie der Schlafkrankheit eignen. Ein Vergleich der Strukturen der Mitoribosomen von Trypanosomen und Menschen k?nnte es erm?glichen, Substanzen zu finden, die gezielt Mitoribosomen des Einzellers hemmen und so als Medikament dienen. Finanziell unterstützt wurde die vorliegende Studie durch den Schweizerischen Nationalfonds.
Literaturhinweis
Ramrath DJF, Niemann M, Leibundgut M, Bieri P, Prange C, Horn EK, Leitner A, Boehringer D, Schneider A, Ban N. Evolutionary shift towards protein-based architecture in trypanosomal mitochondrial ribosomes. Science, published online 13th Sept 2018, DOI: externe Seite 10.1126/science.aau7735