Magnetische Bakterien als Mikropumpen
ETH-Wissenschaftler nutzen magnetische Bakterien, um auf der Mikroebene Flüssigkeiten zu beeinflussen. Sie denken bereits an einen Einsatz in der menschlichen Blutbahn, um damit Krebsmedikamente pr?zise zu einem Tumor zu bringen.
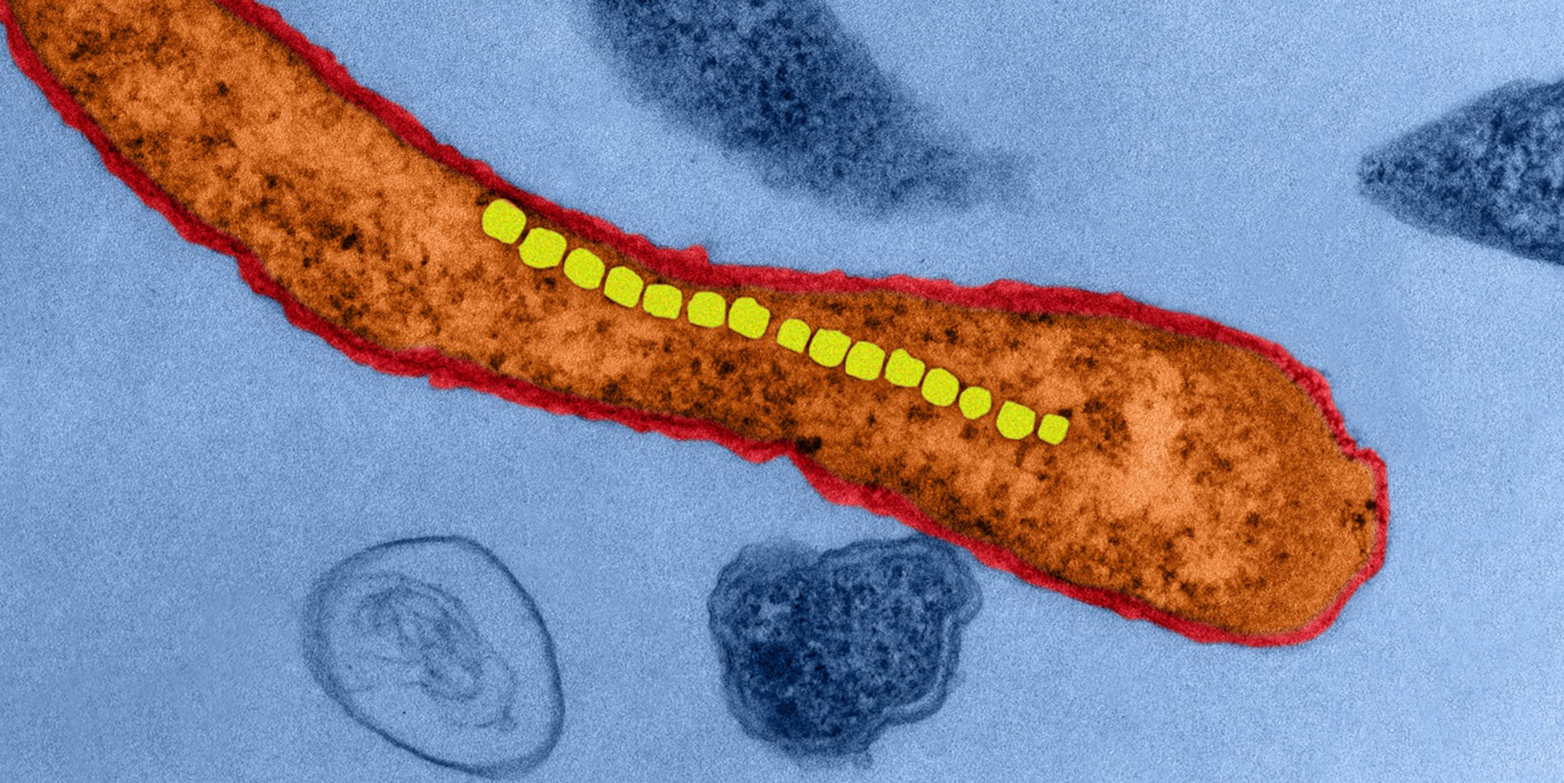
Krebsmedikamente haben Nebenwirkungen. Deshalb verfolgen Wissenschaftler schon seit Jahren Ans?tze, wie die Wirkstoffe im K?rper m?glichst pr?zise zu einem Tumor transportiert werden k?nnen. Die Medikamente sollen nur dort ihre Wirkung entfalten. Ein Ansatz ist, sie in die Blutbahn zu injizieren und ihren Transport in den feinen Blutgef?ssen von Tumoren mit winzigen Vehikeln zu steuern. So existieren in Forschungslabors Mikroroboter, die in Form und Antrieb von Bakterien inspiriert und klein genug sind, um sie in Blutgef?sse einbringen zu k?nnen. Diese Mikrovehikel lassen sich von ausserhalb des K?rpers über ein sich bewegendes Magnetfeld antreiben.
Simone Schürle, Professorin am Departement Gesundheitswissenschaften und Technologie, geht nun einen Schritt weiter: Statt von Bakterien inspirierte Mikroroboter m?chte sie echte Bakterien, die natürlicherweise magnetisch sind, verwenden. Forschende haben solche magnetotaktische Bakterien vor 45 Jahren im Meer entdeckt. Die Mikroorganismen nehmen das im Wasser gel?ste Eisen auf. In ihrem Innern bilden sich Eisenoxid-Kristalle, die sich in einer Reihe anordnen. Wie eine Kompassnadel richten sich diese Bakterien am Erdmagnetfeld aus, um so im Gew?sser navigieren zu k?nnen.
Mit Magnetfeldern punktgenau steuern
ETH-Professorin Schürle untersuchte mit ihrem Team, wie sich diese Bakterien im Labor ebenfalls über ein Magnetfeld steuern lassen, womit man den Fluss von Flüssigkeiten kontrolliert beeinflussen kann. In den Experimenten reichten bereits verh?ltnism?ssig schwache rotierende Magnetfelder, um die Bakterien zu steuern. Mit den rotierenden Feldern konnten die Wissenschaftler die Bakterien um ihre eigene Achse drehen lassen. Und mit vielen Bakterien in einem Schwarm war es m?glich, die sie umgebende Flüssigkeit zu bewegen. Die Bakterien erzeugen einen ?hnlichen Effekt wie eine Mikropumpe und k?nnen so in der Flüssigkeit vorhandene Wirkstoffe in verschiedene Richtungen bewegen, wie zum Beispiel aus der Blutbahn heraus ins Tumorgewebe. Durch die Verwendung von sich überlagernden Magnetfeldern, die sich ?rtlich gegenseitig verst?rken, beziehungsweise ausl?schen, kann man diese Pumpaktivit?t auf eine kleine Region punktgenau reduzieren, wie das Team um Schürle in Simulationen zeigen konnte.
Zudem kann das Prinzip ausserhalb des K?rpers genutzt werden, um in kleinsten Gef?ssen verschiedene Flüssigkeiten lokal miteinander zu mischen, ohne mechanische Mikropumpen fabrizieren und steuern zu müssen.
Tot oder lebend
In ihrer Arbeit ist es vor allem darum gegangen, den Ansatz zu erforschen und zu beschreiben, auf welche Weise die Bakterien den Fluss steuern k?nnen. Bevor solche Bakterien im menschlichen K?rper angewandt werden k?nnen, muss erst noch deren Sicherheit untersucht werden. Bakterien aus medizinischen Gründen in den K?rper zu bringen, ist allerdings ein Ansatz, den die Wissenschaft unter dem Begriff ?Living Therapeutics? bereits verfolgt, wenn auch mit anderen Bakterienarten, wie zum Beispiel Kolibakterien.
Denkbar ist zudem, für eine künftige medizinische Anwendung andere als natürliche Bakterien zu verwenden. Mittels synthetischer Biologie lassen sich Bakterien mit optimalen funktionellen Eigenschaften konstruieren, die im menschlichen K?rper auch sicher sind und zum Beispiel keine allergischen Reaktionen ausl?sen. Schürle kann sich sowohl den Einsatz von Bakterien vorstellen, die abget?tet werden, bevor sie in den K?rper eingebracht werden, als auch von lebenden Bakterien.
Eigener Antrieb für Feinsteuerung
Seit mehreren Jahrzehnten ist ausserdem bekannt, dass sich bestimmte Bakterien, die ohne Sauerstoff auskommen, in Krebspatienten bevorzugt im sauerstoffarmen Gewebe von Tumoren anreichern. Untersucht wurde das in anderen Bakterien als den von Schürles Team verwendeten. Mittels synthetischer Biologie k?nnten die Vorzüge mehrerer Bakterienarten vereint werden. So k?nnten Bakterien entstehen, die sich dank einem eigenen Antrieb mit Flagellen (Geisseln) dem Tumor ann?hern und die man mit magnetischen Kr?ften von aussen gezielt tief ins Tumorgewebe bef?rdern kann.
Literaturhinweis
Mirkhani N, Christiansen MG, Schuerle S: Living, Self‐Replicating Ferrofluids for Fluidic Transport, Advanced Functional Materials 2020, 30: 2003912, doi: externe Seite 10.1002/adfm.202003912