Bei einer angeborenen Missbildung des Herzens spielt ein bisher unbekanntes Protein eine Schlüsselrolle, wie Forschende an der ETH Zürich nun aufgezeigt haben. Die Erkenntnisse weisen neuen Behandlungsm?glichkeiten den Weg.
In Kürze
- Im Gewebe von Babys mit einer schweren Form der Fallot-Tetralogie, einem angeborenen Herzfehler, ist ein Protein namens BBLN stark erh?ht.
- Forschende der ETH Zürich konnten in Versuchen bei M?usen zeigen, wie sie die biochemischen Signalwege rund um dieses Protein ver?ndern müssen, um die für die Fallot-Tetralogie typische Herzumbildung zu stoppen.
- Von diesen Erkenntnissen k?nnten Betroffene dereinst profitieren, wenn es gelingt, darauf basierende Wirkstoffe zu finden.
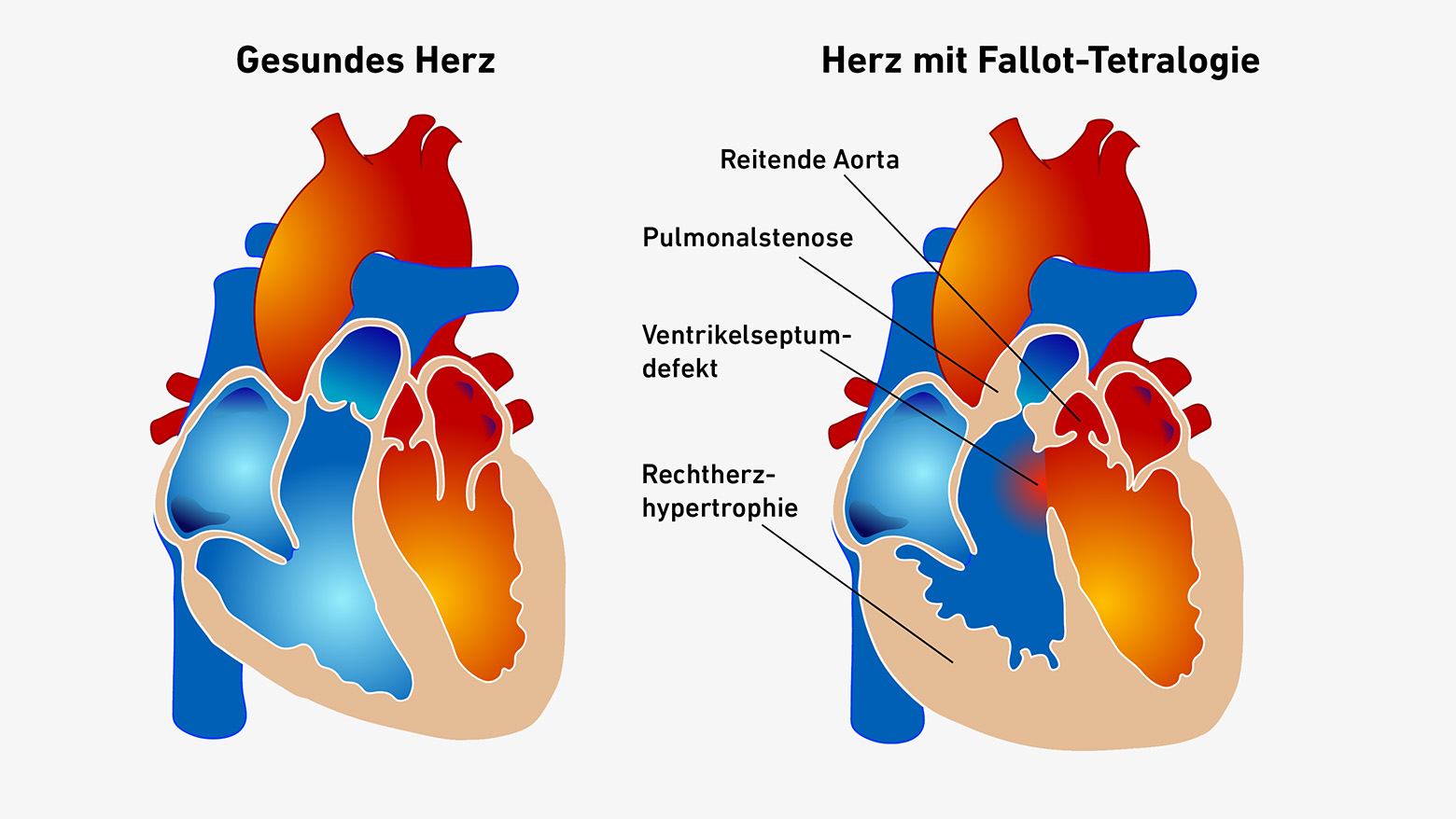
Die sogenannte Fallot-Tetralogie geh?rt zu den h?ufigsten angeborenen Herzfehlern – und gleichzeitig zu den seltenen Erkrankungen, denn die komplizierte Missbildung tritt nur bei drei bis fünf von 10‘000 Neugeborenen auf. Aus noch ungekl?rten Gründen bilden sich die Herzen der Betroffenen gleich in vier Bereichen fehlerhaft aus: So weist etwa die Trennwand zwischen den beiden Herzkammern ein Loch auf. Der Ausfluss zur Lungenarterie ist verengt, die Aorta nach rechts verschoben. Und mit der Zeit verdickt sich der Herzmuskel auf der rechten Seite.
Bl?uliche Verf?rbung bei Sauerstoffmangel
Je nach Schweregrad k?nnen die Fehlbildungen dazu führen, dass der Lungenkreislauf kurzgeschlossen wird: Dann pumpt das Herz das aus dem K?rper einstr?mende Blut gleich wieder in die Aorta statt in die Lungenarterie. Doch wenn das Blut in den Lungen keinen frischen Sauerstoff tanken kann, verf?rbt sich der eigentlich rote Blutfarbstoff H?moglobin ins Bl?ulich-Violette. ?Babys mit einer schweren Form der Fallot-Tetralogie sind blau. Man sieht ihnen den Sauerstoffmangel an?, sagt Ursula Quitterer, Professorin für molekulare Pharmakologie an der ETH Zürich.
Sie und ihr Team versuchen schon seit 15 Jahren, den pathologischen Mechanismen der Fallot-Tetralogie auf die Schliche zu kommen. Jetzt ist es ihnen mit Versuchen an genetisch ver?nderten M?usen gelungen, einige wichtige Puzzlesteine zusammenzufügen – und sich ein genaueres Bild des komplexen Geschehens im missgebildeten Herzen zu machen, wie sie in der Fachzeitschrift externe Seite Nature Cardiovascular Research berichten.
Weisser Fleck auf der Proteinlandkarte
Im Zentrum der Untersuchungen steht ein kleines Protein, das in Quitterers Worten ?einen weissen Fleck auf der Proteinlandkarte? darstellte – und bis vor kurzem nicht mal einen eigenen Namen hatte. Seit zwei Jahren heisst es BBLN (Bublin Coiled-Coil Protein), weil Fadenwürmer ohne dieses Protein winzige Blasen im Darm bilden, wie Forschende aus den Niederlanden nachgewiesen haben.
Auf das nur wenig erforschte Protein stiess das Team um Quitterer in Herzgewebeproben von Kleinkindern, die mit der Fallot-Tetralogie geboren – und sp?ter im Universit?tsspital in Kairo operiert – wurden. Im Vergleich mit Gewebeproben von nicht verf?rbten jungen Fallot-Tetralogie-Patientinnen und -Patienten fanden die Forschenden im Herzgewebe von blauen Babys sechsfach erh?hte Konzentrationen von BBLN vor.
Krankhaft vergr?sserte Nagetierherzen
Um zu erkunden, was diese Hochregulation bewirkt, schuf das Team um Quitterer genetisch ver?nderte M?use, die in ihren Herzen menschliches BBLN herstellten. Je mehr dieses Proteins vorhanden war, desto st?rker vergr?sserten sich die Herzen der M?use – und desto ?fter versagte ihr Herz. Weiterführende Untersuchungen brachten die molekularen Wechselwirkungen ans Licht, die die rechtsseitige Verdickung des Herzmuskels orchestrieren.
?Dieser ungünstige Umbau, der das schlechte Herz noch schlechter macht, findet auch im Menschen statt?, erkl?rt Quitterer. In reichen L?ndern wie der Schweiz werden die jungen Patientinnen und Patienten heute zwar oft schon im S?uglingsalter operiert. Und dank den grossen Fortschritten in der Operationstechnik lassen sich mit dem herzchirurgischen Eingriff auch alle vier Defekte früh beheben.
Suche nach hemmenden Wirkstoffen
Dadurch konnte die Medizin die Lebenserwartung der Betroffenen zwar erheblich verbessern. Aber in den Herzzellen wirken die pathologischen Mechanismen auch nach der Operation noch weiter. ?Deshalb haben Patientinnen und Patienten mit reparierten Fallot-Herzen ein erh?htes Risiko für langfristige Komplikationen wie etwa Herzinsuffizienz?, gibt Quitterer zu bedenken.
In den Versuchen mit den genetisch ver?nderten M?usen hat ihr Team aufgezeigt, welche molekularen Schaltstellen man wie umlegen muss, um den sch?dlichen Umbau des Herzens aufzuhalten. Von diesen Erkenntnissen k?nnten Betroffene dereinst profitieren, wenn es gelingt, Wirkstoffe zu finden, die gezielt BBLN – oder seine Wechselwirkungen mit anderen Proteinen – hemmen. Mit der Suche nach solchen Substanzen haben Quitterer und ihr Team schon begonnen.
Literaturhinweis
Abd Alla J, Langer A, Wolf S, Fu X, Abdelfattah Rageh M, Quitterer U: BBLN triggers CAMK2D pathology in mice under cardiac pressure overload and potentially in unrepaired hearts with tetralogy of Fallot. Nature Cardiovascular Research, 26. Oktober 2023, doi: externe Seite 10.1038/s44161-023-00351-6