Realit?tsnahe Simulationen zeigen, wie sich Samen- und Eizelle aneinanderkoppeln, bevor sie verschmelzen. Dadurch gelang es Forscherinnen der ETH Zürich, gleich mehrere R?tsel der Befruchtung zu l?sen. Dies k?nnte helfen, Unfruchtbarkeit gezielter zu behandeln.
In Kürze
- Ein ETH-Forschungsteam visualisiert erstmals die Befruchtungsdynamik menschlicher Eizellen durch Simulationen auf Hochleistungsrechnern.
- Die Simulationen zeigen, wie sich ein Protein auf der Spermienoberfl?che durch Freisetzung von Zink-Ionen nach einer Befruchtung der Eizelle ver?ndert.
- Dies verhindert, dass das verformte Protein an eine Andockstelle auf der Eizellen-Oberfl?che binden kann.
- Die entschlüsselten Mechanismen k?nnten neue Wege aufzeigen, um Unfruchtbarkeit zu behandeln oder medikament?se Verhütungsmethoden zu entwickeln.
Wer kennt ihn nicht, den Blick durchs Mikroskop, in dessen Fokus ein Spermium in eine Eizelle eindringt und diese befruchtet. Das geht dynamisch vor sich und scheinbar problemlos. Zoomt man jedoch in die Prozesse hinein, die bei einer Befruchtung auf molekularer Ebene ablaufen, wird es hochkomplex. Es überrascht deshalb nicht, dass weltweit 15 Prozent der Paare unfruchtbar sind. Kein noch so modernes Mikroskop kann die unz?hligen Interaktionen zwischen den beteiligten Proteinen abbilden. Was den Befruchtungsprozess ausl?st und was auf molekularer Ebene kurz vor der Verschmelzung von Spermium und Eizelle passiert, blieb daher im Dunkeln - bis jetzt.
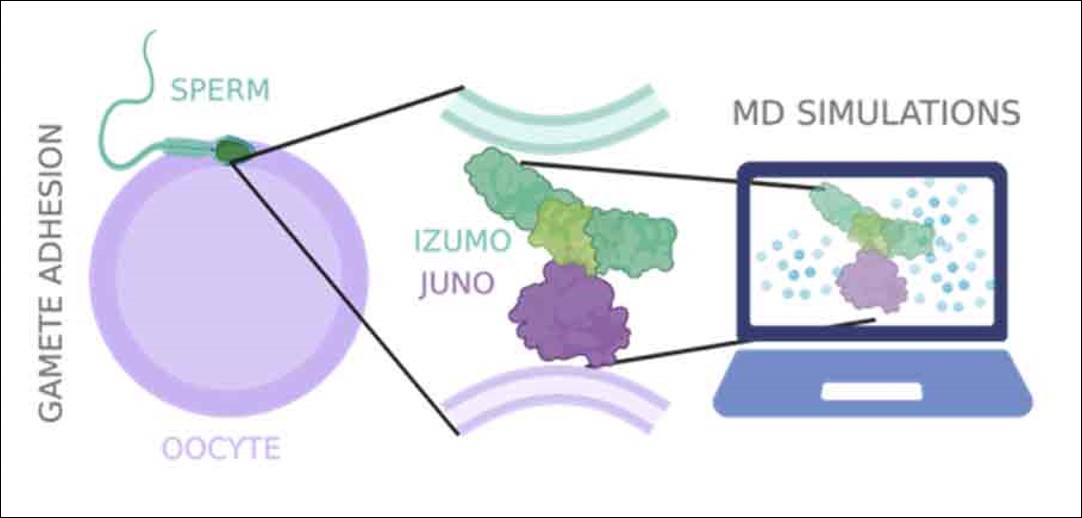
Mit Hilfe von Simulationen auf ?Piz Daint?, dem Supercomputer des Nationalen Hochleistungsrechenzentrums der Schweiz (CSCS), machte nun ein Forschungsteam unter der Leitung von ETH-Professorin Viola Vogel die Dynamik dieser entscheidenden Prozesse bei der Befruchtung einer menschlichen Eizelle erstmals sichtbar. Mit den Simulationen sei es gelungen, ein wichtiges Geheimnis der Befruchtung auf einzigartige Weise zu lüften, schreiben die Forscherinnen in ihrer Studie, die kürzlich in der Fachzeitschrift Scientific Reports publiziert wurde.
Spezieller Proteinkomplex erm?glicht die Fusion
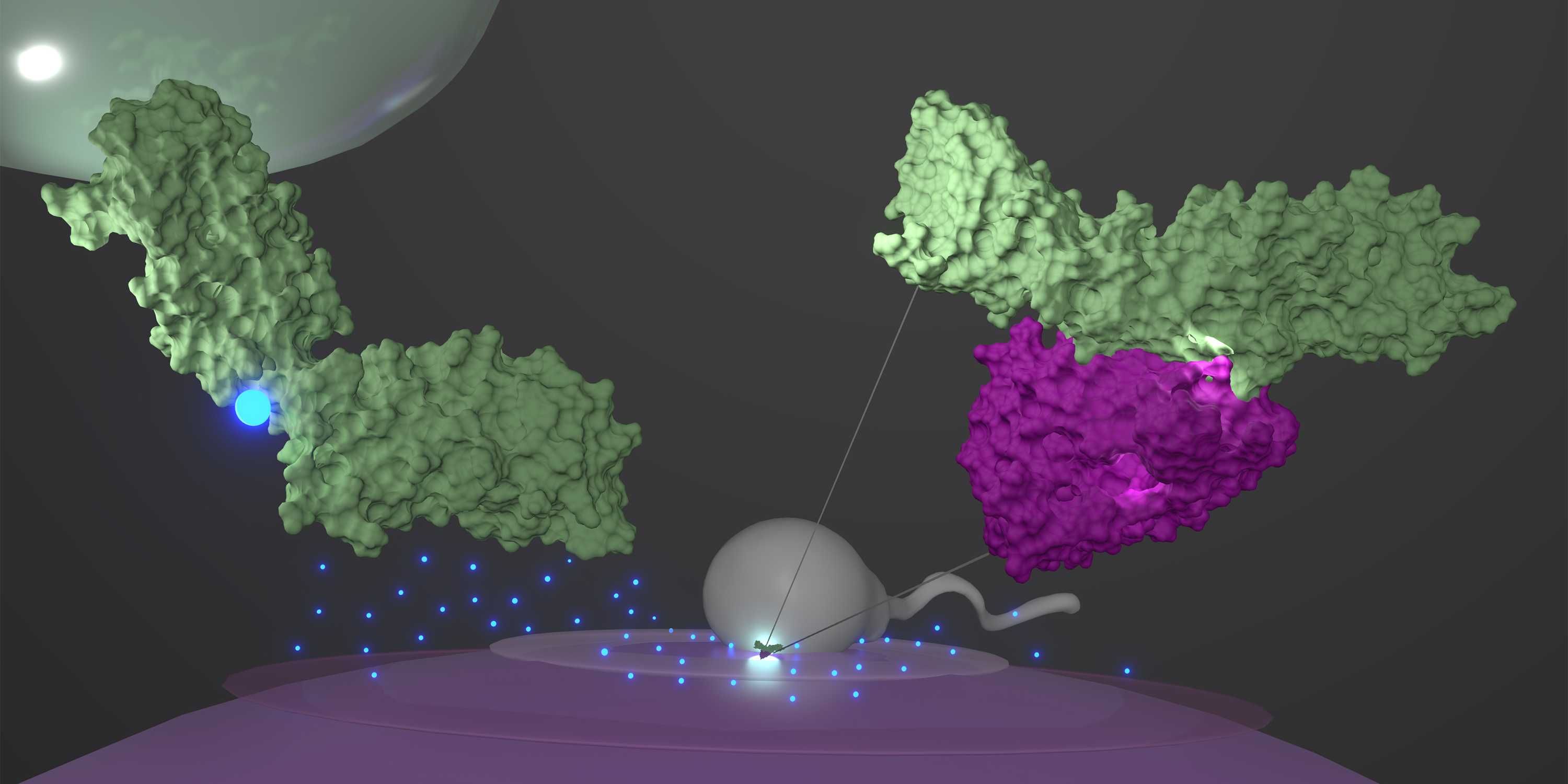
Bisher bekannt war, dass der Proteinkomplex, der die erste physische Verbindung zwischen den beiden Keimzellen herstellt, aus zwei Proteinen besteht: einerseits aus dem Protein Juno, das auf der ?usseren Membran der weiblichen Eizelle sitzt, andererseits aus dem Protein Izumo1 auf der Oberfl?che des m?nnlichen Spermiums. ?Man geht davon aus, dass die Verbindung der beiden Proteine zu einem Komplex den Erkennungs- und Adh?sionsprozess zwischen den Keimzellen einleitet und dadurch ihre Verschmelzung erm?glicht?, sagt Paulina Pacak, Postdoktorandin in Viola Vogels Gruppe und Erstautorin der Studie. Bis anhin konnten Wissenschaftlerinnen und Wissenschaftler den Mechanismus anhand von Kristallstrukturen jedoch nicht eindeutig beschreiben.
Dies gelang dem ETH-Forschungsteam nun anhand ihrer neusten Simulationen. Um eine realit?tsnahe Umgebung im Computerexperiment herzustellen, simulierten die Forscherinnen Juno und Izumo1 in einer w?ssrigen L?sung. Im Wasser bewegt sich das Protein jedoch und die Wechselwirkungen mit den Wassermolekülen ver?ndern sowohl die Art und Weise wie die Proteine aneinanderbinden als auch teilweise die Funktion der Proteine selbst. ?Das macht die Simulationen viel komplexer, auch weil Wasser allein bereits eine hochkomplexe Struktur besitzt?, sagt Vogel. ?So ergeben die Simulationen ein detaillierteres Bild der Dynamik der Interaktionen.?
Die Simulationen über eine Zeitspanne von jeweils 200 Nanosekunden zeigen, dass der Juno-Izumo1-Komplex durch ein Netzwerk von über 30 kurzlebigen Kontakten stabilisiert wird. Allerdings halten die einzelnen Bindungen weniger als 50 Nanosekunden. Den Forscherinnen zufolge er?ffnet ein tieferes Verst?ndnis dieser Netzwerkdynamik der schnell wechselnden Bildung und Aufl?sung einzelner Verbindungen neue M?glichkeiten für die Entwicklung von Verhütungsmitteln und es hilft beim Verst?ndnis von Mutationen, die sich auf die Fruchtbarkeit auswirken.
Zink-Ionen regulieren Bindungsst?rke
Basierend auf dieser sichtbar gemachten Netzwerkdynamik gingen die Forscherinnen dann der Frage nach, wie diese lebenswichtige Proteinbindung destabilisiert werden k?nnte. Eine wichtige Rolle spielen dabei Zink-Ionen (Zn2+): Sind sie anwesend, verbiegt sich Izumo1 zu einer Art Boomerang. Die Simulationen zeigen, dass Zink-Ionen Izumo1 in dem Boomerang-f?rmigen Zustand stabilisieren und Izumo1 infolgedessen nicht mehr an das Protein Juno binden kann. Das k?nnte laut den Forscherinnen ein Grund dafür sein, weshalb die Eizelle direkt nach der Befruchtung kurzfristig viele Zink-Ionen freisetzt, einen sogenannten ?Zink Spark?. Dieser bewirkt, dass das gebogene Protein Izumo1 nicht mehr an Juno binden kann – und damit verhindert, dass weitere Spermien in die Eizelle eindringen und eine Fehlentwicklung der Eizelle bewirken.
?So etwas k?nnen wir nur mit Hilfe von Simulationen herausfinden. Erkenntnisse, die wir aus ihnen ableiten, w?ren auf der Grundlage der statischen Kristallstrukturen von Proteinen kaum m?glich?, betont Vogel. ?Die hochdynamischen Vorg?nge der Befruchtung finden weit entfernt vom Gleichgewicht statt. Da die verfügbaren Strukturen die Proteine eingebettet im Kristall zeigen, sind Ressourcen wie die des CSCS essenziell, um deren Dynamik zu erfassen und zu verstehen.?
Fols?urebindung durch Izumo1
Dank der Simulationen konnten die Forscherinnen ein weiteres R?tsel entschlüsseln: wie natürlich vorkommende Folate und ihre synthetischen ?quivalente, die Fols?uren, an das Juno-Protein binden. Es ist bekannt, dass Folate wichtig für die neuronale Entwicklung des F?tus sind. Werdenden Müttern wird deshalb empfohlen, bereits vor einer geplanten Schwangerschaft und w?hrend der ersten drei Monaten Fols?ure-Pr?parate einzunehmen. Laborexperimente wiesen jedoch darauf hin, dass das Protein Juno in w?ssriger L?sung Folat nicht an sich bindet, obwohl Juno selbst ein Folat-Rezeptor ist. Die molekulardynamischen Simulationen zeigten nun, dass Folat nur in die mutmassliche Folat-Bindungstasche von Juno hineingelangen kann, wenn Juno gleichzeitig auch an Izumo1 gebunden ist.
Diese neuen Entdeckungen sind nicht nur von grundlegendem Interesse für die Strukturbiologie. Sie liefern auch detaillierte Grundlagen für die Entwicklung pharmazeutischer Wirkstoffe. Davon sind die Forscherinnen überzeugt. Die entschlüsselten dynamischen Mechanismen des Zusammenspiels der Proteine Juno und Izumo1 k?nnten laut den Forscherinnen neue Wege aufzeigen, um Unfruchtbarkeit zu behandeln, medikament?se nicht-hormonelle Verhütungsmethoden zu entwickeln und die In-vitro-Fertilisationstechnik zu verbessern.
Dieser Artikel von Simone Ulmer erschien zuerst auf der Website des externe Seite CSCS.
Literaturhinweis
Pacak P, Kluger C, Vogel V: Molecular dynamics of JUNO-IZUMO1 complexation suggests biologically relevant mechanisms in fertilization. Sci Rep 13, 20342 (2023). DOI: externe Seite 10.1038/s41598-023-46835-0