Mit Gedanken Gene steuern
ETH-Forscher um Martin Fussenegger haben das erste Gen-Netzwerk entwickelt, das über Hirnstr?me in Gang gesetzt wird und je nach Gedanken unterschiedliche Mengen eines gewünschten Moleküls produziert. Pate stand ein Spiel, das ebenfalls Hirnstr?me abgreift, um damit einen Ball durch einen Hindernisparcours zu lenken.
Es klingt beinahe wie in der Weltraum-Saga ?Star Wars?, in der Meister Yoda dem jungen Luke Skywalker beibringt, wie man durch die Kraft der Gedanken den X-Wing Starfighter aus dem Sumpf birgt: Marc Folcher sowie weitere Forscherinnen und Forscher aus der Gruppe von Martin Fussenegger, Professor für Biotechnologie und Bioingenieurwissenschaften am Departement Biosysteme (D-BSSE) in Basel, haben eine neuartige Genregulationsmethode entwickelt, bei der Gedanken – respektive die spezifischen Hirnstr?me, die sie erzeugen - die Umsetzung von Genen in Proteine, in der Fachsprache Expression genannt, steuern.
?Es ist uns zum ersten Mal gelungen, menschliche Hirnstr?me abzugreifen, diese drahtlos an ein Gen-Netzwerk zu übertragen und die Expression eines Gens, je nach Art der Gedanken, zu regulieren. Die Kontrolle von Genexpression durch die Macht der Gedanken war ein Traum, den wir seit über einem Jahrzehnt verfolgen?, sagt Fussenegger.
Eine Inspirationsquelle für das neue durch Gedanken kontrollierte Gen-Regelwerk war das Spiel ?Mindflex?. Dabei tr?gt ein Spieler eine Art Kopfh?rer mit Sensor auf der Stirn, der die Hirnstr?me aufzeichnet. Das registrierte Elektroenzephalogramm (EEG) wird dann in die Spielumgebung übertragen. Dabei kontrolliert das EEG einen Ventilator, um so einen kleinen Ball durch einen Hindernisparcours zu lenken.
Drahtlose ?bertragung auf Implantat
Das System, das die Basler Bioingenieure soeben in ?Nature Communications? vorgestellt haben, besteht nun ebenfalls aus einem EEG-Kopfh?rer. Die aufgefangenen Hirnstr?me werden ausgewertet und drahtlos via Bluetooth an einen Controller übertragen. Dieser steuert einen Feldgenerator, der ein elektromagnetisches Feld erzeugt, welches ein Implantat induktiv mit Strom versorgt.
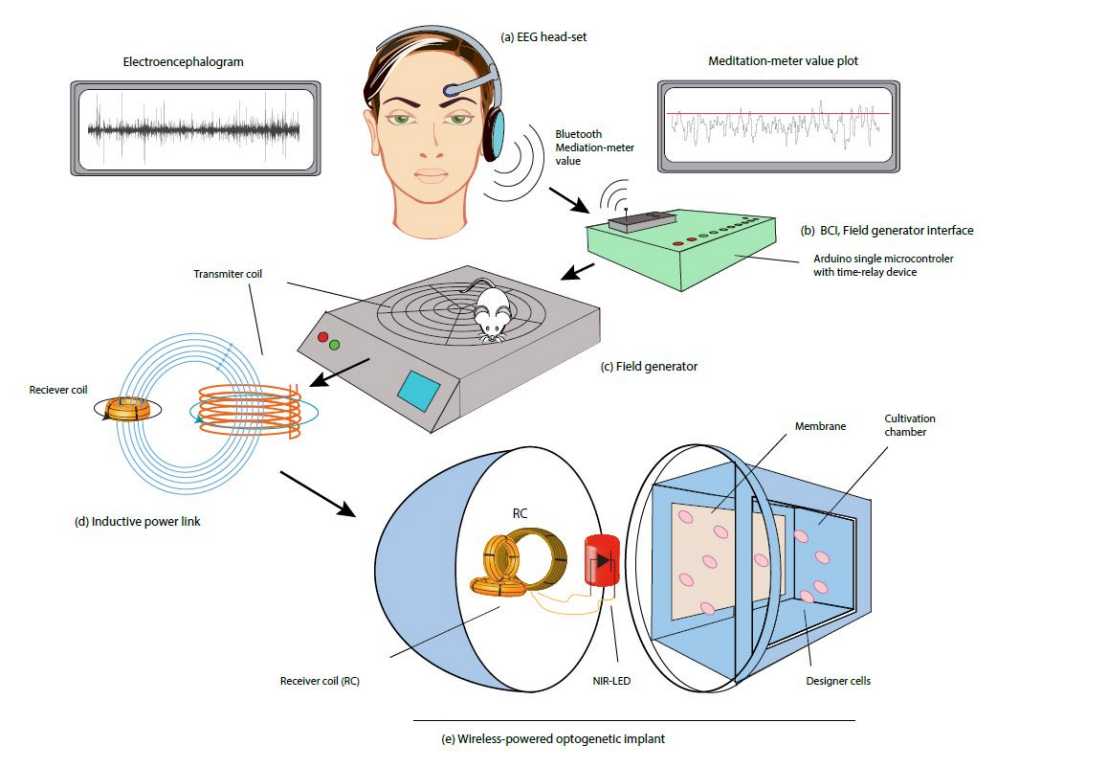
Im Implantat geht danach buchst?blich ein Licht auf: Ein integriertes LED-L?mpchen, das Licht im Nah-Infrarotbereich abstrahlt, schaltet sich an und beleuchtet eine Kulturkammer mit genetisch ver?nderten Zellen. Sobald das Nah-IR-Licht die Zellen anstrahlt, beginnen diese mit der Herstellung des gewünschten Proteins.
Gedanke steuert Proteinmenge
Das Implantat wurde vorerst in Zellkulturen und in M?usen getestet, gesteuert durch die Gedanken verschiedener Testpersonen. In ihren Tests arbeiteten die Forschenden mit SEAP, einem einfach nachzuweisenden menschlichen Modell-Eiweiss, das aus der Kulturkammer des Implantates in den Blutkreislauf der Maus diffundiert.
Um die Menge des freigesetzten Proteins zu regulieren, mussten sich die Testpersonen in drei verschiedene Gedankenzust?nde versetzen: Biofeedback, Meditation und Konzentration. Testpersonen, welche am Computer Minecraft spielten, sich also konzentrierten, induzierten mittlere SEAP-Werte im Blutkreislauf der M?use, w?hrend im Zustand v?lliger Entspannung, also bei Meditation, sehr hohe SEAP-Blutwerte in den Versuchstieren erreicht wurden. Beim Bio-Feedback beobachteten die Testpersonen das LED-Licht des Implantats im K?rper der Maus und konnten durch diese visuelle Rückkopplung ihrer Gedanken das LED-Licht bewusst m?glichst lange ein- oder ausschalten. Dies wiederum schlug sich in wechselnden Mengen an SEAP im Blutkreislauf der Tiere nieder.
Neues lichtempfindliches Genkonstrukt
?Eine solche Gen-Steuerung ist komplett neu und in ihrer Einfachheit einzigartig?, führt Fussenegger aus. Eine Neuentwicklung sei insbesondere das lichtempfindliche optogenetische Modul, welches auf Nah-Infrarotlicht reagiert. Dabei trifft das Licht auf ein modifiziertes lichtempfindliches Protein im Inneren von genver?nderten Zellen und l?st dort eine künstliche Signalkaskade aus, an deren Ende die Herstellung von SEAP steht. Nah-Infrarot wurde deshalb verwendet, weil es für menschliche Zellen weitgehend unsch?dlich ist, tief ins Gewebe einzudringen vermag und die Funktion des Implantates visuell verfolgt werden kann.
Das existierende System funktioniert im Mensch-Zellkultur- und Mensch-Maus-System einwandfrei. Fussenegger hofft, dass ein gedankengesteuertes Implantat dereinst helfen k?nnte, neurologische Erkrankungen wie chronische Kopf- und Rückenschmerzen sowie Epilepsie durch spezifische Hirnstr?me frühzeitig zu erkennen. Dadurch k?nnte die rechtzeitige Bildung gewisser Wirkstoffe in eingesetzten Implantaten ausgel?st und gesteuert werden.
Literaturhinweis
Folcher M, Oesterle S, Zwicky K, Thekkottil T, Heymoz J, Hohmann M, Christen M, Daoud El-Baba M, Buchmann P, Fussenegger, M: Mind-controlled transgene expression by a wireless-powered optogenetic designer cell implant. Nature Communications, Online-Publikation vom 11. November 2014, doi: externe Seite 10.1038/ncomms6392