Mit magnetischen Bakterien Tumore bekämpfen
Forschende der ETH Zürich m?chten magnetische Bakterien zur Bek?mpfung von Krebsgeschwüren nutzen. Sie haben nun einen Weg gefunden, wie die Mikroorganismen die Blutgef?sswand gut durchdringen und anschliessend einen Tumor besiedeln k?nnen.
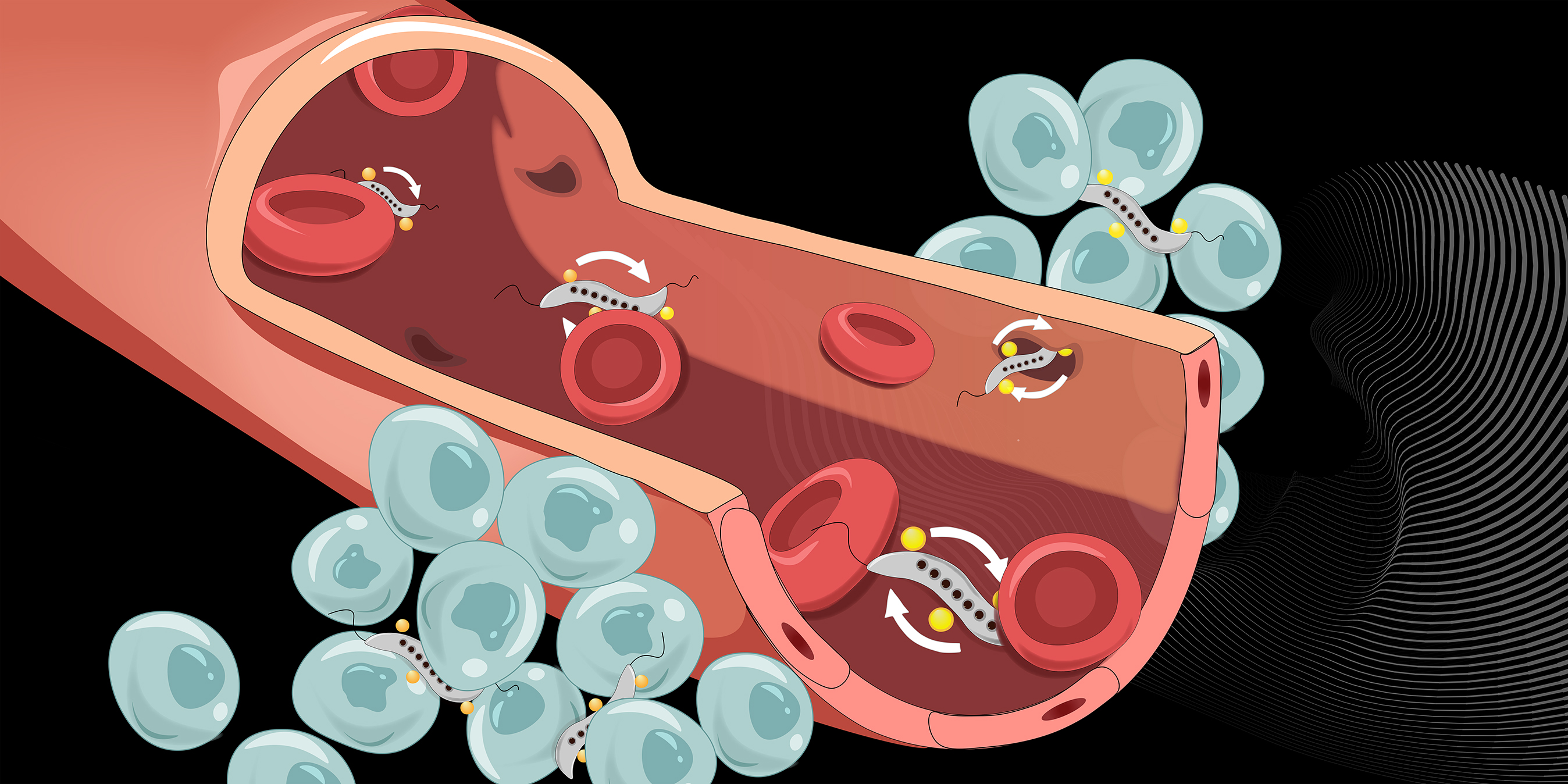
Wissenschaftler:innen weltweit erforschen, wie Krebsmedikamente am effizientesten zu Tumoren gelangen, wo sie ihre Wirkung entfalten sollen. Eine M?glichkeit ist, ver?nderte Bakterien als F?hren zu benutzen, welche die Wirkstoffe durch die Blutbahn hin zu den Tumoren transportieren. Forschende an der ETH Zürich haben es nun geschafft, bestimmte Bakterien so zu steuern, dass sie effizient die Blutgef?sswand durchdringen und ins Tumorgewebe eindringen k?nnen.
Als Modellbakterien nutzten die Forschenden um Simone Schürle, Professorin für reaktionsf?hige biomedizinische Systeme, solche, die natürlicherweise magnetisch sind, weil sie Eisenoxid-Partikel enthalten. Diese Bakterien der Gattung Magnetospirillum reagieren auf Magnetfelder und k?nnen von ausserhalb des K?rpers mit Magneten gesteuert werden, siehe dazu einen früheren Artikel in ETH-News.
Tempor?re Lücken nutzen
Schürle und ihr Team haben nun in Zellkultur und in M?usen gezeigt: Ein auf den Tumor gerichtetes rotierendes Magnetfeld eignet sich besonders gut, dass die Bakterien die Blutgef?sswand in Tumorn?he durchdringen. An der Gef?sswand treibt das rotierende Magnetfeld die Bakterien zu einer vorw?rts gerichteten Drehbewegung an.
Um das Durchdringen der Gef?sswand besser zu verstehen, ist ein detaillierter Blick auf diese n?tig: Die Blutgef?sswand ist die Barriere zwischen der Blutbahn und dem Tumorgewebe, das von vielen feinen Blutgef?ssen durchzogen ist. Sie besteht aus einer Schicht von Zellen. Bestimmte Moleküle aus dem Blutstrom k?nnen durch die engen Zwischenr?ume zwischen den Zellen schlüpfen und damit die Gef?sswand passieren. Wie gross der Zellzwischenraum ist, wird von den Gef?sswandzellen reguliert. Vorübergehend k?nnen die Zellen den Zwischenraum auch so weit ?ffnen, dass andere Zellen (und damit auch Bakterien) die Gef?sswand passieren k?nnen.
Starker Antrieb und hohe Wahrscheinlichkeit
Ein Antrieb der Bakterien über ein rotierendes Magnetfeld ist aus drei Gründen wirksam, wie die ETH-Forschenden mit Experimenten und Computersimulationen zeigen konnten. Erstens ist diese Antriebsart besonders stark, so dass sich die Bakterien besonders gut durch die engen Zellzwischenr?ume zw?ngen k?nnen. Der Antrieb über ein rotierendes Magnetfeld ist zehnmal st?rker als ein Antrieb über ein statisches Magnetfeld, das nur die Richtung vorgibt und bei dem sich die Bakterien mit eigener Kraft fortbewegen müssen.
Zweitens sind die durch das Rotationsfeld angetriebenen Bakterien st?ndig in Bewegung; sie t?nzeln der Blutgef?sswand entlang. Dadurch ist die Wahrscheinlichkeit, dass sie auf eine sich kurz ?ffnende Lücke zwischen den Gef?sswandzellen treffen, h?her als bei den anderen Antriebsarten, bei denen sich die Bakterien weniger dynamisch bewegen. Und drittens müssen die Bakterien im Gegensatz zu anderen Methoden für die Steuerung nicht über Bildgebung nachverfolgt werden. Ist das Magnetfeld einmal auf den Tumor ausgerichtet, werden vorbeistr?mende Bakterien vom Magnetfeld erfasst.
Fracht im Tumorgewebe angereichert
?Wir nutzen auch die natürliche und autonome Fortbewegung der Bakterien?, erkl?rt ETH-Professorin Schürle. ?Haben die Bakterien die Blutgef?sswand einmal passiert und sind sie im Tumor, k?nnen sie autonom tief in ihn eindringen.? Den Antrieb über das externe Magnetfeld nutzen die Wissenschafter:innen daher nur w?hrend einer Stunde, damit die Bakterien die Gef?sswand effizient überwinden und den Tumor erreichen k?nnen.
In Zukunft k?nnten solche Bakterien mit Krebsmedikamenten beladen werden. Im Rahmen ihrer Zellkulturstudien simulierten die ETH-Forschenden dies mittels Liposomen (Nanobl?schen aus fettartigen Stoffen), die sie den Bakterien anh?ngten. Diese Liposomen waren mit einem fluoreszierenden Farbstoff gefüllt. Auf diese Weise konnten die Wissenschaftler:innen in der Petrischale nachweisen, dass die Bakterien ihre Fracht tats?chlich ins Innere von Krebsgewebe gebracht haben, wo sie sich anreicherte. In einer künftigen medizinischen Anwendung würde statt des Farbstoffs ein Medikament verwendet.
Bakterielle Krebstherapie
Der hier verfolgte Ansatz, Bakterien als F?hren für Wirkstoffe zu nutzen, ist nur einer von zwei M?glichkeiten zur Verwendung von Bakterien in der Krebsmedizin. In der Wissenschaft erlebt derzeit ein weiterer, über hundert Jahre alter Ansatz ein Revival: Bakterien bestimmter Arten k?nnen Tumore sch?digen. M?glicherweise sind mehrere Wirkmechanismen daran beteiligt. Bekannt ist jedenfalls, dass die Bakterien bestimmte Zellen des Immunsystems anregen, die dann gegen den Tumor vorgehen.

?Wir denken, dass wir mit unserem Ingenieur-Ansatz die Wirksamkeit der bakteriellen Krebstherapie erh?hen k?nnen.?Simone Schürle
Derzeit gibt es mehrere Forschungsprojekte, in denen die Wirksamkeit von Bakterien der Art Escherichia coli gegenüber Tumoren untersucht werden. Heute ist es m?glich, die Bakterien mittels synthetischer Biologie zu ver?ndern, um ihre therapeutische Wirkung zu optimieren, Nebenwirkungen zu reduzieren und die Sicherheit zu erh?hen.
Nicht-magnetische Bakterien magnetisieren
Doch auch wenn man die inh?renten Eigenschaften von Bakterien in der Krebstherapie nutzen m?chte, stellt sich die Frage, wie diese Bakterien effizient zu einem Tumor gelangen. Bei Krebsgeschwüren nahe der K?rperoberfl?che ist es m?glich, die Bakterien in den Tumor zu injizieren. Bei solchen tief im K?perinnern wird das schwierig. Hier kommt die Mikrorobotik von ETH-Professorin Schürle ins Spiel. ?Wir denken, dass wir mit unserem Ingenieur-Ansatz die Wirksamkeit der bakteriellen Krebstherapie erh?hen k?nnen?, sagt sie.
Die in den Krebsstudien verwendeten Bakterien der Art Escherichia coli sind nicht magnetisch und lassen sich daher nicht über ein Magnetfeld antreiben und steuern. ?berhaupt ist Magnetismus unter Bakterien ein sehr seltenes Ph?nomen. Magnetospirillum ist eine der wenigen Bakteriengattungen, welche diese Eigenschaft haben.
Schürle m?chte daher auch Escherichia-coli-Bakterien magnetisch machen. Damit k?nnte es dereinst m?glich sein, medizinisch wirksame Bakterien ohne natürlichen Magnetismus über ein Magnetfeld zu steuern.
Literaturhinweis
Gwisai T, Mirkhani N, Christiansen MG, Nguyen TT, Ling V, Schuerle S: Magnetic torque-driven living microrobots for increased tumor infiltration, Science Robotics 26. Oktober 2022, doi: externe Seite 10.1126/scirobotics.abo0665